Norges Teknisk–Naturvitenskapelige
Universitet
Institutt for materialteknologi
Faglig kontakt under eksamen:
Martin Ystenes, tlf. 73 5 (9 40 08), mobil 9511 2502
EKSAMEN I TMT4100
Kjemi (Bygg og geofag–linjer)
Fredag, 16. desember 2005
Tid: kl. 09.00 – 13.00 (4 timer)
Bokmål
Hjelpemidler: B2
– Typegodkjent kalkulator, med tomt minne, i henhold til liste utarbeidet av
NTNU, tillatt.
– Aylward & Findlay, ”SI Chemical Data” (SI–CD)
Angi framgangsmåte og
viktige mellomregninger ved løsing av regneoppgaver. Nødvendig informasjon tas
fra SI–CD, vedlagte figurer og en formelsamling som finnes bakerst i oppgaven
I alle oppgaver er
det antatt at temperaturen er 25EC, unntatt der annen informasjon er gitt.
Alle oppgaver skal
besvares. Alle oppgaver teller like mye, men er ikke nødvendigvis like
tidkrevende. Les derfor gjennom oppgavene før du begynner beregningene. (a– og
b–spørsmålene teller likt.) Det er en fordel om du begynner hver oppgave med et
nytt ark.
Når du ikke finner
svar på en oppgave og trenger tallsvaret for å gå videre på neste oppgave, så
må du anta et svar.
Oppgave 1–6 tilsvarer
delex (deleksamen) 1–6. Inntil 5 resultater kan du ta med deg fra deleksamen,
og du gjør det på denne måten:
– Har du bestått en
delex (75–100 %) slipper du å gjøre hele oppgaven delex tilsvarer.
– Har du halvt bestått en delex (63–74 %) slipper du å gjøre a–oppgaven med samme
nummer som delex.
– Har du ”litt bestått” på en delex (50–62 %) skal du gjøre heile oppgaven, men
du er garantert 40% score på a–oppgaven
med samme nummer som delex.
Spørsmålene i oppgavene 1–6 er på samme form
som på delex, de skal gjøres fort og besvares kort. Sammenlignet med
arbeidsmengden på delex er beregnet tid på oppgave 1–6 til sammen kun 60 – 90
min. Bli ikke hengende på enkeltoppgaver
som bare teller 1 poeng!
Løsningsforslag vil bli
lagt ut på Internett så snart som mulig etter at eksamen har startet, på http://ex.ystenes.com
Lykke til!
Oppgave 1. Tilsvarer delex I. Spørsmålene skal besvares så kort som mulig!
a) – Angi navn og
formler for tre syrer som ved 1M konsentrasjon har en pH på eller meget nær 0.
– Angi navn og formel for en base som ved 1M konsentrasjon har en pH på eller
meget nær 14.
– Angi navn og formel for de saltene som oppstår når hver av de tre syrene
blandes med støkiometriske mengden av basen, dvs. i molforhold 1:1.
– Skriv løsningsreaksjonen for saltene og angi hvorvidt disse saltene er lett
løselige, tungt løselige eller uløselige.
b) – Angi formel for
ammoniumsulfat og magnesiumhydrogenfosfat.
– Nitrogendioksid vil i vann reagere og danne like store mengder av
salpetersyre og salpetersyrling. Skriv den balanserte reaksjonsligningen.
– Hva kalles saltene av svovelsyre og svovelsyrling?
– Hvilke to allotroper av oksygen finnes, og hvilke oksidasjonstall har O i
disse to?
– Hvilke to hydrogenforbindelser danner oksygen, og hvilke oksidasjonstall har
O i disse to?
Oppgave 2. Tilsvarer delex II. Spørsmålene skal besvares så kort som mulig!
a)
– 10–3 mol fast NaOH løses i 0,1 L vann. Hva er pH, [OH–],
[Na+] og [NaOH] i løsningen?
– Skriv opp uttrykket for og verdien av likevektskonstanten for oppløsning av
Al(OH)3.
– Hva er løseligheten av Al(OH)3 ved pH=8?
– En løsning av 0,03 M Al(NO3)3 tilsettes sterk base til
pH = 8. Al(OH)3 felles. Hva er [Al3+]?
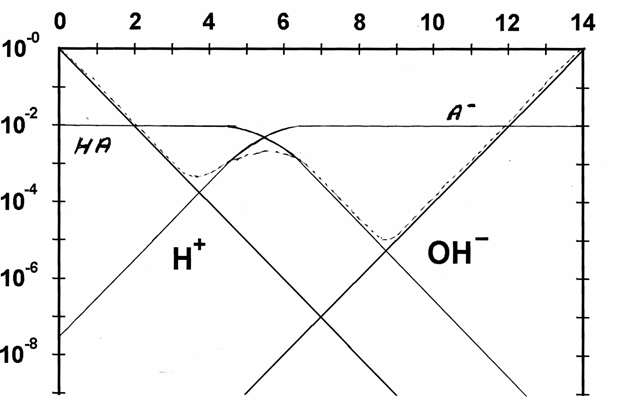
b) Vedlagt oppgavene finner du et pH/log[X]–diagram
for en ukjent syre, HA. Bufferkapasiteten er inntegnet.
– Hva er Ka
for syren?
– Hva er [HA] + [A–]?
– Hva er konsentrasjon av de ulike stoffene ved pH = 5?
– Hva er pH hvis man tilsetter 0,01 mol HA i 1L rent vann?
– Ved hvilken pH ville pH endre seg mest ved tilsats av en dråpe HCl, hvis [HA]
+ [A–] = 0,01M?
Oppgave 3. Tilsvarer delex III. Spørsmålene skal besvares så kort som mulig!
Du har 1 L tørr luft ved 25 ºC ved 1 atm.
Luften behandles som ideell gass bestående av 79 mol–% nitrogen og 21 mol–%
oksygen. Dette er utgangspunktet for alle beregningene i oppgave 3.
a) – Hvor stort blir
trykket hvis du komprimerer gassen til 1/3 L? T og n er konstant.
– Hvilken temperatur ville gitt fordoblet trykk? V og n er konstant.
– Hva er n? Hvor mange mol O2 og hvor mange mol N2 har
du?
– Hvor mye varme må du tilføre for å varme opp luften fra 25 ºC til 50 ºC? P er
konstant,
– Hva er dannelsesreaksjonen og dannelsesentalpien for oksygen og NO?
b) – Totaltrykket økes til 1,1 atm og T økes til 40 ºC. Hva er P(N2)?
– Hva er løseligheten av N2 i vann i kontakt med luft ved 1,1 atm totaltrykk
og T = 40 ºC?
– Hva blir løseligheten hvis du komprimerer gassvolumet til det halve, og
deretter pumper inn helium til trykket er 12 atm uten å endre volumet? T er
konstant.
– Hvor mye varme frigjøres eller dannes hvis 1 mol NO omdannes til nitrogen og
oksygen?
– Hvis NO ved 25 ºC spaltes i nitrogen og oksygen og all varme blir i
produktene, hva blir temperaturen i produktene etter reaksjonen?
Oppgave 4. Tilsvarer delex IV.
a)
Ta utgangspunkt i reaksjonen Fe2O3
+ 3 CO → 2 Fe + 3 CO2. Partialtrykket
av CO2 er 10–2 atm, mens partialtrykket av CO er 10–5
atm. Totaltrykket er 1 atm og de faste stoffene er rene.
–
Finn ΔGº for reaksjonen ved 25 ºC.
– Finn verdien av likevektskonstanten for reaksjonen ved 25 ºC.
– Finn verdien av Q.
– Beregn ΔG for reaksjonen ved 25 ºC.
– Hvilken vei går reaksjonen? Begrunn svaret ut fra ΔG.
b)
Ta utgangspunkt i reaksjonen C + CO2
→ 2 CO.
– Finn ΔGº for reaksjonen ved 100 ºC.
– Finn verdien av likevektskonstanten for reaksjonen ved 100 ºC.
– Beregn partialtrykket av CO2 ved likevekt når partialtrykket av CO
er 10–5 atm. T = 100 ºC.
– Ved hvilken temperatur er reaksjonen i likevekt hvis partialtrykket av CO er
10–5 atm, og de øvrige er i standard tilstand?
Oppgave 5. Tilsvarer delex V.
a) Daniell–cellen kan skrives slik: Zn | Zn2+
(aq) || Cu2+ (aq) | Cu
– Finn
halvreaksjonene og totalreaksjonen.
– Finn standard cellespenning for reaksjonen.
– Bestem hva som er anode og katode, og fortegnene på elektrodene. Begrunn
valgene.
– Beregn E hvis metallene er rene og løsningene er 1 M ZnCl2 og 0,01
M Cu(NO3)2.
– Forklar ut fra Nernsts ligning hvorfor spenningen synker etter hvert som
reaksjonen går.
b)
Ta utgangspunkt i følgende celle: Pt | O2
| H+ (1M) || OH– (1M) | O2 | Pt
–
Beregn E for cellen ved 25 ºC ut fra halvreaksjoner som gir E = Eº.
– Beregn E for cellen ved 25 ºC ut fra halvreaksjoner som gir Eº = 0.
– Ved 40ºC målte du E til 0,75 V. Hva er, ut fra dette måleresultatet, Kw
ved 40ºC?
Oppgave 6. Tilsvarer delex VI.
a) Tegn opp følgende molekyler. Vis alle atomer
og bindinger. Det kreves ingen forklaring.
– Metan, etan, eten,
propyn og propadien.
– Tre mettede molekyler med 4 C–atomer, ett som er lineært, ett forgrenet og
ett som er en ring.
– Tre forskjellige alkoholer med formelen C3H6O, men som
ikke danner en ring.
– En eter, en ester og en syre, alle med to karbonatomer.
– 1,1–dimetylbutyl acetat.
b) Tegn opp følgende molekyler. Vis alle atomer
og bindinger. Det kreves ingen forklaring.
– Vis sammenheng
mellom strukturene for PVC (polyvinylklorid) og polypropen.
– Hvordan vil en kopolymer av like mye propen og etyn se ut, hvis annenhver
monomer er propen og annenhver er etyn?
– Tegn en syre og en alkohol som sammen kan danne en polyester.
– Vis at en aminosyre (f. eks. 1–amin propansyre) kan danne et polyamid.
– En syre med fire syregrupper, C(COOH)4 og en alkohol med 4
OH–grupper, C(CH2OH)4, reagerer og danner en polymer.
Tegn resultatet. Her er det nok å skissere strukturen.
Oppgave 7.
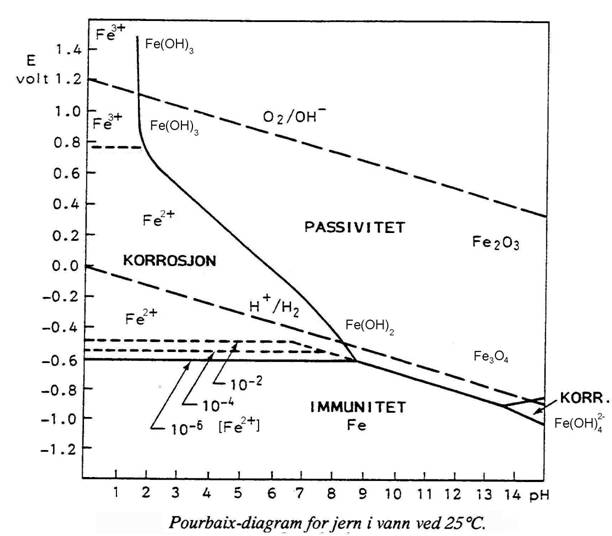
a) Vedlagt oppgavene finner du Pourbaix–diagrammet
for jern. Utgangspunktet for oppgaven er en situasjon hvor E = 0,9 V og pH=5.
Det er ingen påtrykt spenning og ingen andre forbindelser til stede utover de
som finnes i eller dannes fra vann, jern og luft.
– Hva er det som
skaper spenningen? Hvilken praktiske situasjon kan gi E = 0,9 V ved pH=5?
– Forklar, ut kjemiske likevekter, hvorfor jern korroderer eller ikke korroderer
hvis pH = 5 og E = 0,9 V.
– Forklar, ut fra kjemiske likevekter, hvordan pH påvirker hvorvidt jern vil
korrodere eller ikke.
– Forklar, ut fra kjemiske reaksjoner, hvordan E påvirker hvorvidt jern vil
korrodere eller ikke.
– Vil det kunne endre situasjonen at man tilsatte salt? Begrunn svaret med en kjemisk
likevekt.
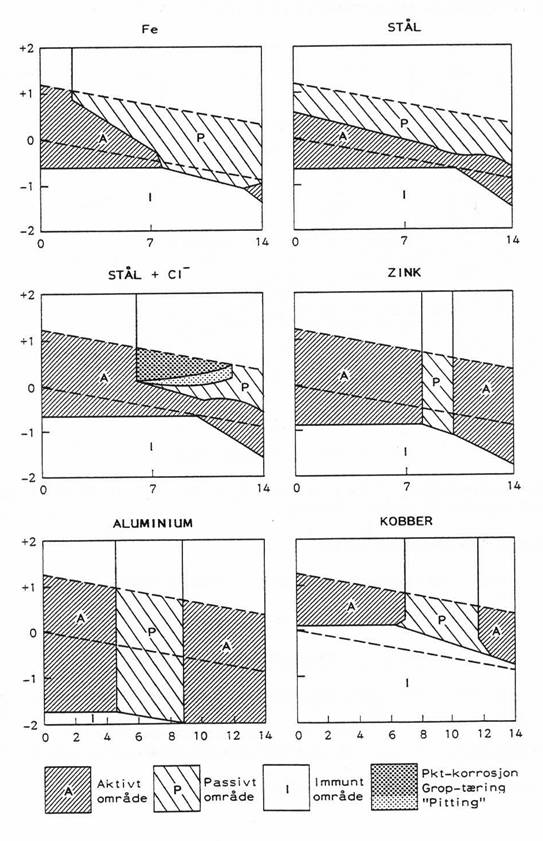
b) Et jernrør og et kobberrør er koblet sammen.
Gjennom det sammenkoblede røret transporteres drikkevann til et hus og røret
ligger nedgravd i tørre omgivelser.
– Vil det kunne
oppstå galvanisk korrosjon? Forklar hvor eventuell korrosjon vil skje og angi
forutsetningene for at galvanisk korrosjon skal kunne skje.
– Hvis du skal hindre korrosjon, hvilken del av røret vil du da male? Begrunn
svaret.
– Gi en oversikt over hvilke faktorer som bestemmer korrosjonshastigheten i den
aktuelle situasjonen.
– Angi hvilke informasjoner du måtte ha hvis du skulle beregne
korrosjonshastigheten.
Oppgave 8
a) Klorgass løses i vann ved 25 oC,
1 atm totaltrykk, gassen inneholder 10 vol–% klor. Vannet er sjøvann med 0,1 M
NaCl, og er gjort basisk til pH =13. I vannet reagerer klor etter følgende
reaksjonsligning: Cl2 (aq) + OH– → Cl– + HOCl. Merk
forskjellen mellom Cl2 (g) og
Cl2 (aq)!
– Beregn
likevektskonstanten, K, for reaksjonen Cl2(g) → Cl2 (aq) ut fra
løselighetsdata i tabell 27.
– Beregn ΔGº for løsningsreaksjonen ut fra den beregnede verdien av K.
– Beregn, ut fra verdier i tabell 5 i SI, ΔGº for reaksjonen Cl2
(aq) + OH– → Cl–
+ HOCl.
– Finn verdien for K for reaksjonen Cl2 (g) + OH– → Cl– + HOCl.
– Finn verdien av Q for reaksjonen hvis [HOCl] = 10–3 mol/L.
(Det ble oppdaget at verdier for HOCl manglet
i SI, og det ble da oppgitt at man i stedet kunne bruke verdier for OCl–
eller anta verdier.)
b) En elektrokjemisk celle kan skrives slik: Pt
| Cl2 (g) | Cl– (0,1 M)|| Cl– (0,1M)| Cl2
(aq) | Pt. Begge løsningene er sure, så det skjer ingen reaksjon mellom klor og
vann.
– Finn halvreaksjonene
og totalreaksjonen.
– Finn n og Eº for totalreaksjonen.
– Finn likevektskonstanten for totalreaksjonen. Kommenter hvorvidt resultatet
var som forventet eller ikke.
– Beregn E hvis den venstre cellen har 1 atm totaltrykk og gassen inneholder 10
mol–% klor. Alle andre komponenter er i standard tilstand.
– Hva er forutsetningen for at [Cl–] skal kunne påvirke E for
totalreaksjonen?
Oppgave 9.
a) Om vannets struktur og egenskaper. Alle disse spørsmålene kan besvares kort.
– Vannmolekylet har
polare kovalente bindinger. Gjør rede for hva dette er, og forklar hvorfor vann
har slike bindinger.
– Forklar hvorfor vannmolekylet er vinklet, og hvorfor bindingsvinkelen er
mindre enn 109,5º.
– Fordi vannmolekylet er bøyd er det polart. Hva har dette å si for vannet
kokepunkt og dets egenskaper som løsemiddel?
– Hvorfor har vann et mye høyere kokepunkt enn det langt tyngre og
polare molekylet H2S?
– Hvorfor har CO2 en langt høyere løselighet enn O2 i
vann, selv om begge gassene er upolare?
b) Om bindinger i faste stoffer. Alle disse spørsmålene
kan besvares kort.
– Forklar hvordan man kan forutsi hvilke bindinger et fast stoff har ut
fra elektronegativitet.
– Forklar forskjellen mellom molekylstruktur og gitterstruktur når det gjelder
kjemiske bindinger.
– Hvorfor har N2 et veldig lavt kokepunkt, selv om N2 har
de sterkeste av alle kjemiske bindinger?
– Forklar hvorfor polyeten og polypropen har mye lavere smeltepunkt enn PVC
(polyvinylklorid).
– Forklar hvorfor noen plaststoffer ikke kan smeltes om når de først er laget
ferdig og har fått sin endelige form.
Oppgave 10.
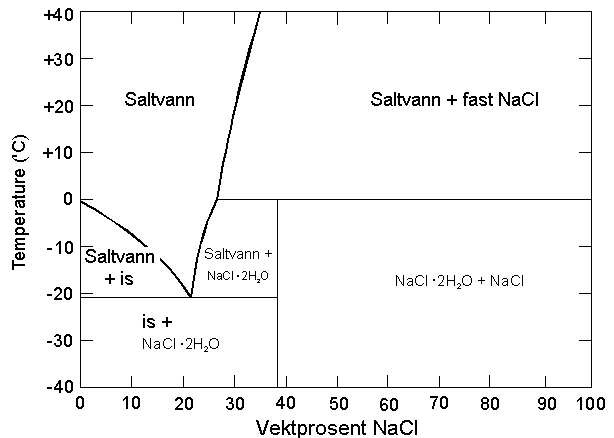
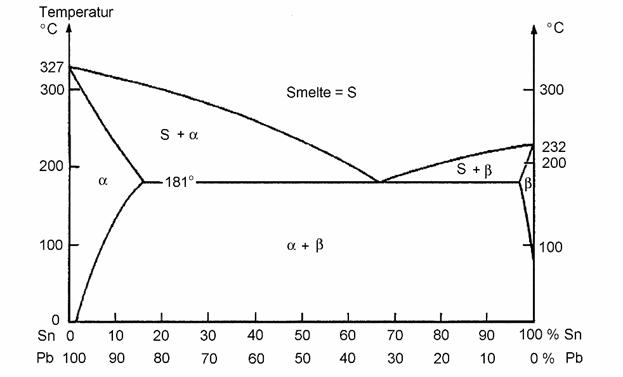
a) Vedlagt oppgavene finnes fasediagram for
Pb/Sn og vann/NaCl.
– Forklar hvorfor saltvann har høyere kokepunkt og lavere smeltepunkt
enn ferskvann, og angi kort hvordan du vil beregne frysepunktet.
– 18 karat gull inneholder 58,5 % gull, resten sølv og/eller kobber. Hva har
høyest smeltepunkt av rent gull og 18 karat gull? Begrunn svaret.
– Du har en blanding av 70 % bly og 30 % tinn og temperaturen er 200 ºC.
Hvilke to faser har du, hvor mye har du av hver fase, og hva er sammensetningen
av hver av de to fasene?
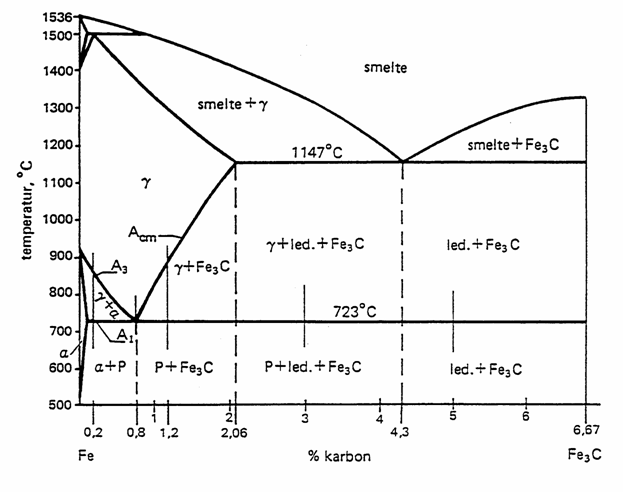
b) Vedlagt oppgavene finnes fasediagrammet for
jern/sementitt.
– Jern kan maksimalt ha oppløst ca. 2 % karbon i sin struktur. Forklar
ved hvilken temperatur det skjer, og hva som skjer hvis temperaturen øker eller
minker.
– Hvilke egenskaper har sementitt (cementitt), sammenlignet med jern?
– Stål er mye sterkere enn vanlig jern. Dette kan forklares ut fra at stål har
en struktur som kan sammenlignes med en kompositt. Jernet er armert av lameller
av sementitt, og kombinasjonen gir både stor strekkstyrke og bruddstyrke.
Forklar hvorfor det dannes en slik struktur. Forklar ut fra jernets ulike
strukturer, fast løsning og fasediagrammet for jern/sementitt.
Vedlegg til oppgavene på de
neste sidene.
FORMELSAMLING
for TMT4100 og TMT4105/4106
Det er formler her som ikke er nødvendige i
dette faget.
_____________________________________________________________________________
Formel Kommentar
_____________________________________________________________________________
PV = nRT; n = PV/RT Den ideelle gasslov; Avogadros lov.
Pi = niRT/V;
Pi = Xi ∙ Ptot; Ptot = Σ Pi Partialtrykk av i; Xi er molbrøk av i.
C = q / ΔT; ΔH =IC dt C
= varmekapasitet.
ΔE = q + w Pass
på definisjon av retningene for q og w.
H = E + PV H = Entalpi.
ΔH = q q er her tilført varme.
ΔHE = Σ ΔfHº(produkter) – Σ ΔfHº(reaktanter) Husk støkiometriske faktorer.
ΔHET ≈ ΔHº298
+ ΔCºp
∙ ΔT Eksakt
hvis ΔCºp
er konstant.
ln K1/K2
= – ΔH/(R
(1/T1 – 1/T2)) van=t Hoff. ΔH og ΔS konstant.
ln P1/P2 = – ΔvapH/(R (1/T1 – 1/T2)) Clausius–Clapeyron for væskers damptrykk.
dS = qrev/T S = Entropi.
ΔSET ≈ ΔSE298 + ΔCpE∙ ΔlnT Eksakt hvis ΔCºp er konstant.
G = H – TS; ΔG = ΔH – TΔS Gibbs
energi = – T ∙ ΔSunivers.
ΔGT ≈ ΔH298 – TΔS298 Eksakt hvis ΔH og ΔS er konstant.
ΔG = ΔGº + RTlnQ Q
er reaksjonsbrøken.
ΔGº = –RTlnK Fordi ΔG = 0 ved likevekt.
ΔG = –nFE E
= cellespenning.
q = It = F Strømmengde
for 1 mol elektroner.
E = Eº – (RT/nF) lnQ;
E = Eº – (0,0592/n) logQ Nernst
ligning; ved 25 ºC.
[H+] ∙ [OH–] = Kw = 10–14 pH + pOH = 14.
e(a+b) = ea
∙ eb; ln ea = a; ln(a/b) = ln a – ln b Regneregler
for logaritmer og eksponenter