Transport av terapeutiske makromolekyler i kreftvev
Det blir tilbudt 2 oppgaver innen denne problemstillingen
Et av hovedproblemene ved konvensjonell
kreftbehandling som stråleterapi og kjemoterapi, er at behandlingene ikke er
spesifikke for kreftcellene. Den ioniserende strålingen og cellegiften
ødelegger både normalt vev og kreftvev, og skadene på normalt vev begrenser
dosene som kan benyttes.
Ulike strategier for å utvikle kreftspesifikke
behandlinger er foreslått. Utviklingen av monoklonale antistoffer som binder
seg til kreftspesifikke antigener på overflaten av kreftcellene gav håp om en
ny og kreftspesifikk behandling. Monoklonale antistoffer kan benyttes som
bærere for radioaktive isotoper, toksiner eller andre giftstoffer. Genterapi
basert på DNA vektorer som bærer terapeutiske gen kan bli en annen kreftspesifikk
behandling. Liposomer benyttet som bærere av
cellegift reduserer toksisiteten til normalt vev og øker spesifisiteten for
kreftvev, er et annet eksempel på bruk av makromolekyler. Felles for alle disse
behandlingene er at det benyttes store molekyler med en diameter i
størrelsesorden 10 til 10.000nm, mens konvensjonelle cellegifter små molekyler
med diameter under 1 nm. Slike store molekyler har problemer med å nå fram til
kreftcellene, og det er vist at bare en liten del av makromolekylene som
injiseres intravenøst eller gis oralt når fram til kreftvevet. Om de skal
lykkes å nå fram og drepe kreftcellene avhenger av at det er et godt utviklet
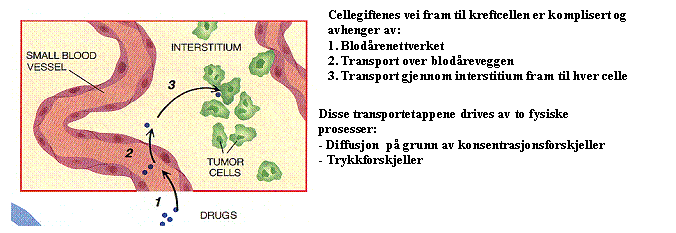
blodårenettverk i svulsten, at molekylene kan passere over kapillærveggen og at
de er i stand til å trenge gjennom rommet mellom kreft cellene (kalt
ekstracellulær matrix
(ECM) eller interstitium). Disse transportetappene avhenger av
diffusjon der fluksen av molekylet er proporsjonal med konsentrasjonsgradienten
og konveksjon der fluksen av molekylet er proporsjonal med den hydrostatiske
trykkgradienten. Det er vist at svulster har et høyere interstitielt
væsketrykk enn normalt vev, og dette er et av hovedproblemene for å få
makromolekyler fram til kreftcellene. Diffusjon kan derfor være den primære
transportmekanismen. Diffusjon er imidlertid en ekstrem sein prosess for store
molekyler og diffusjonskoeffisienten avtar med økende molekylvekt.
1. Diffusjon av ladete makromolekyler i
geler.
Diffusjon er den primære
transportmekanismen dersom det høye interstitielle
væsketrykket umuliggjør transport av molekyler basert på trykkgradienten. I
denne oppgaven blir negativt ladete geler benyttet som en modell for
ekstracellulær matrix i en svulst.
Formål: Kartlegge betydningen som ladning på makromolekylene har
for diffusjon gjennom en ladet ekstracellulær matrix .
Metode: Negativt ladete geler blandes med fluorescensmerkede
antistoff (IgG )som anioniseres og kationiseres.
Diffusjon måles med teknikken ” fluorescence recovery after photobleaching” (FRAP).
2. Intracellulær trafficking av kitosan/DNA nanopartikler:
fotokjemisk internalisering teknologi for økt levering av genmedisiner
Medveileder: Sabina Strand, Inst for bioteknologi, (tlf. 91689)
Formål: Genoverføring er en
nøkkelteknikk i moderne bioteknologi og har et potensiale
som terapi i forbindelse med genetisk betingede sykdommer (genterapi).
Den største bremsen i klinisk anvendelse av genterapi
er mangel på effektive og trygge genleveringsystemer.
For at DNA kan overføres (transfekteres) til celler
og uttrykke ønsket protein, må den effektivt kondenseres ("pakkes
inn") enten i et virus eller en syntetisk nanopartikkel
vha positivt ladede polymerer eller lipider. I disse nanopartiklene
blir terapeutisk gen beskyttet mot nedbrytning og lettere transportert inn i
cellene. Etter celleopptak ved endocytose må nanopartiklene passere flere intracellulære
barrierer på vei til cellekjernen, hvor DNA kargo skal frigjøres for
transkripsjon.
En av de største flaskehalser i en
transfeksjonsprosess er frigjøring/utslipp av nanopartikler fra endosomer og
lysosomer. Flere studier viser at store mengder DNA aldri blir frigjort og brutt ned i lysosomene. Fotokjemisk
internalisering (PCI) er en teknologi som utnytter såkalte photosensitizers for
lys-indusert frigjøring av makromolekyler fra endosomer og lysosomer. Når cellene blir eksponert for lys vil
photosensitizeren som er tatt opp i lysosomer føre til at
lysosomene sprekker og innholdet kommer ut i
cytoplasma.
Inst for bioteknologi har
gjennom mange år jobbet med utvikling av genvektorer
basert på kitosan. Kitosan,
et naturlig forekommende polysakkarid som fremstilles fra krabbe- og
rekeskallet, er en meget lovende bærer for DNA. For videre utvikling av enda
mer effektive vektorer trenger vi bedre forståelse av intracellulær
trafficking av kitosan/DNA nanopartikler. I dag fremstår intracellulær
transport som en ”black box”,
vi vet lite om hvilke trinn som er de mest kritiske i overføringsprosessen. Det
er spesielt uklar hvordan kitosan/DNA nanopartikler unnslipper fra endosomer/lysosomer. Ved å implementere PCI
teknologi, kan vi muligens både øke trasfeksjonseffektivitet
og samtidig få bedre forståelse av hvorvidt frigjøring av vektorer fra endosomer/lysozomer er en
begrensende faktor for genlevering.
Metoder: Kitosan/DNA nanopartikler vil bli
lokalisert i celler og kolokalisert med lysosoner, cytoplasma, og kjerne ved bruk av konfokal
laser scanning mikroskopi (CLSM).
Videre kan flow cytometry
brukes til å kvantifisere opptak av komplekser og levedyktighet.